Перипротезная, парапротезная или параэндопротезная инфекция (ППИ) | Эндопротезирование тазобедренного сустава в Киеве
Обещанное продолжение серии материалов - "Осложнения, возникающие при эндопротезировании больших суставов и их профилактика". Одна из самых, если не самая, дорогая в плане лечения проблема при протезировании - Параэндопротезная инфекция
Опубликован: 07.07.2022Перипротезная, парапротезная или параэндопротезная инфекция (ППИ)
Перипротезная инфекция – глубокая инфекция области хирургического вмешательства, возникшая после имплантации эндопротеза, представляет собой частный случай имплантат ассоциированной инфекции
Обзор материалов из открытых источников. Эксклюзивно для проекта «Травматология и фармакология: точки соприкосновения».
Обещанное продолжение серии материалов – Осложнения, возникающие при эндопротезировании больших суставов и их профилактика. Одна из самых, если не самая, дорогая в плане лечения проблема при протезировании. О ней не принято говорить (чтобы не сглазить) во время планирования, но каждый ортопед-травматолог, который занимается эндопротезированием больших суставов, всегда помнит о ней, как и о ТЭЛА о которой мы писали в первом обзоре осложнений.
И так
Инфекция (параэндопротезная, парапротезная, перипротезная инфекция, ППИ). Инфекционный процесс может возникнуть как в операционной ране, так и глубже, в месте эндопротеза и на его поверхности. Для профилактики и лечения инфекционных осложнений применяют антибиотики, однако при глубоком распространении процесса может потребоваться повторное вмешательство и замена протеза.
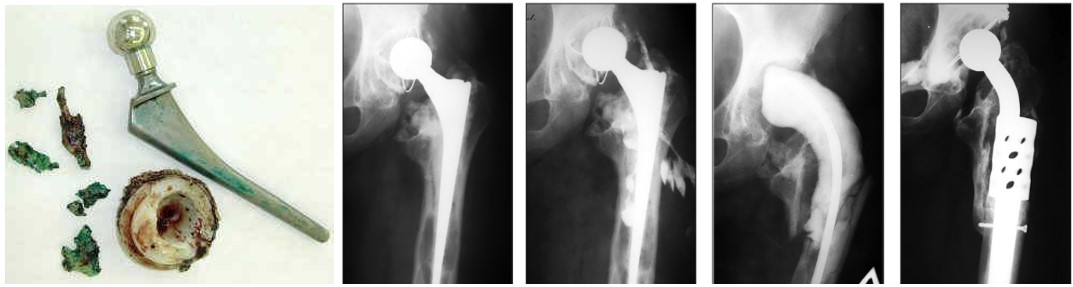
Перипротезная, парапротезная или параэндопротезная инфекция (ППИ)
По данным различных исследований и авторов инфекционные осложнения после эндопротезирования больших суставов нижних конечностей колеблются от 1 до 15% при первичном эндопротезировании и до 25% при ревизионном (повторном) эндопротезировании. (Bloom A.W., Hanssen A.D., 2006. Phillips J.E. 2009. Hsu C.S., 2011, Parvizi J. 2014)
Связано это, в большинстве случаев, с внутрибольничной инфекцией с высокой устойчивостью к антибиотикам. О всемирной проблеме устойчивости инфекций к антибиотикам мы уже писали в наших материалах ранее – «Рекомендации по системной антимикробной терапии при инфицировании перелома», «Инфекции переломов: новые согласования в сфере диагностики и лечения», В повестке дня Давос-2021 и AMR Action Fund - Davos-2021 и AMR Action Fund: стойкость к антибиотикам является новой угрозой для мира.
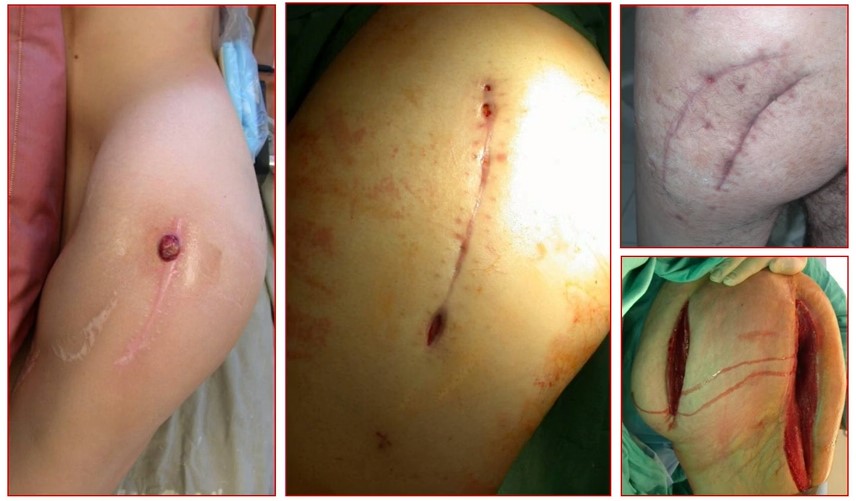
Внешние проявления инфекции в области тазобедренного сустава с наличием эндопротеза: гиперемия и отечность в зоне послеоперационного доступа; функционирующий, закрывающийся или закрывшийся свищ; незаживающие раны в области тазобедренного сустава
Сложности лечения ППИ
Лечение перипротезной инфекции (ППИ) сопровождается:
- минимум двумя дополнительными операциями с потерей костной и мягких тканей;
- длительной госпитализацией с возможным развитием мультирезистентрых штаммов инфекции и сопутствующих осложнений, вплоть до летального исхода;
- увеличением времени пребывания пациента в реанимации в раннем послеоперационном периоде и удорожанием самой операции в разы по сравнению с обычными ортопедическими вмешательствами;
- почти 6-кратным увеличением расходов на лечение, главным образом, за счет медикаментов. Причем около 75% финансовых расходов приходится на современные антибактериальные препараты широкого спектра действия.
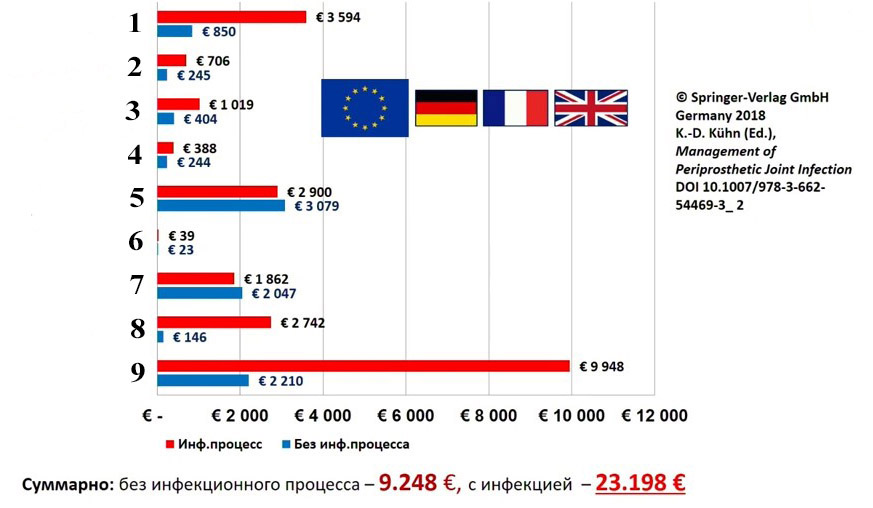
1. Общие расходы 2. Лекарственные препараты 3. Диагностика (радиология, лабораторная) 4. Физиотерапия 5. Вмешательства + анестезия 6. Амортизация активов 7. Стоимость протезирования 8. Назначения помимо протезов 9. Затраты на персонал
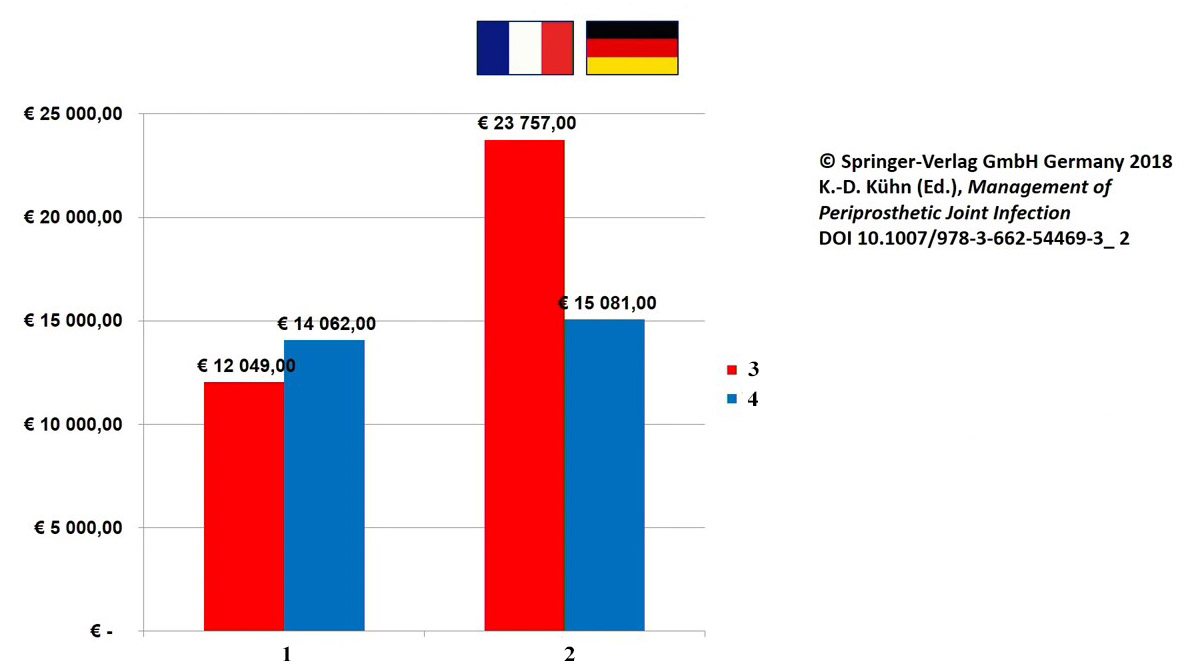
Экономическая составляющая лечения перипротезной инфекции в странах Европы и страховые выплаты 1. Асептическая 2. Септическая 3. Средние расходы на лечение 4. Максимальное страховое покрытие
Факторы риска развития ППИ:
- некомпенсированный сахарный диабет
- курение
- ожирение ( > 20% от индекса массы тела)
- употребление гормональных препаратов
- неполноценное, несбалансированное питание, алкоголизм
- вирусные инфекции (HVC, CMV, AIDS …)
- урогенитальная инфекция
- возраст пациентов старше 70 лет
- дооперационные трансфузии
- системные заболевания и перенесенные инфекционные заболевания суставов и органов (СКВ, ревматоидные артриты, болезнь Бехтерева …)
Кроме перечисленных рисков, большое значение имеет состояние операционной, професионализм оперирующего врача и операционной бригады, тщательное соблюдение всех правил асептики и антисептики во время операции и во время проведения перевязок.
Основные возбудители ППИ
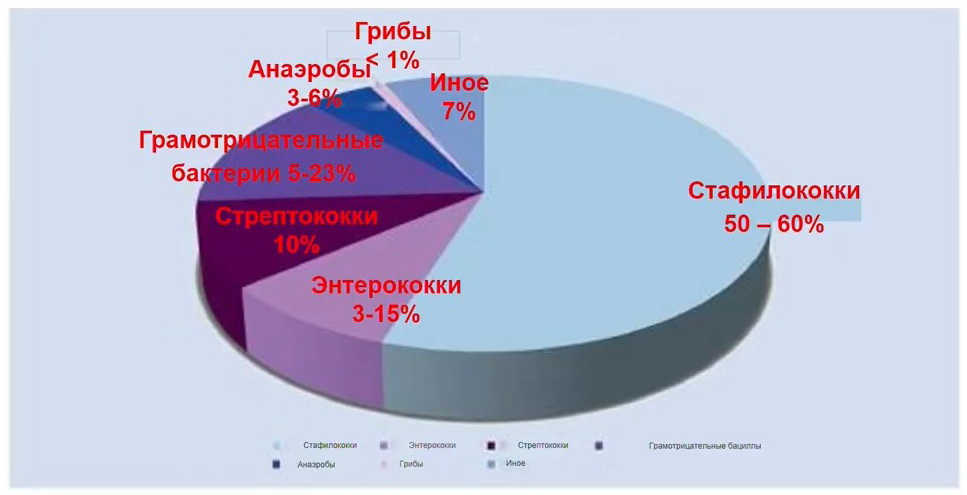
Микроорганизмы, вызывающие ППИ (по данным стран ЕС и Северной Америки)
Как видно на рисунке около 60% ППИ вызывают стафилококки, от 3 до 15% энтерококки, 10% - стрептококки, грамотрицательные бактерии выявляются в 5-23% развития ППИ, остальные случаи — это анаэробная инфекция (3-6%), грибковая инфекция (около 1%) и иные возбудители (около 7%)
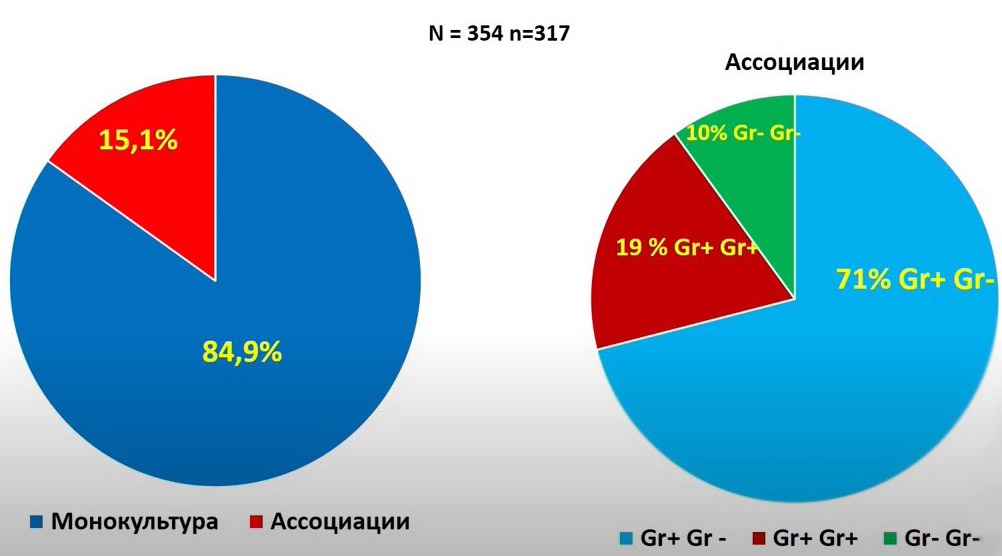
Моно- и ассоциативная, грамположительная и грамотрицательная инфекция при ППИ
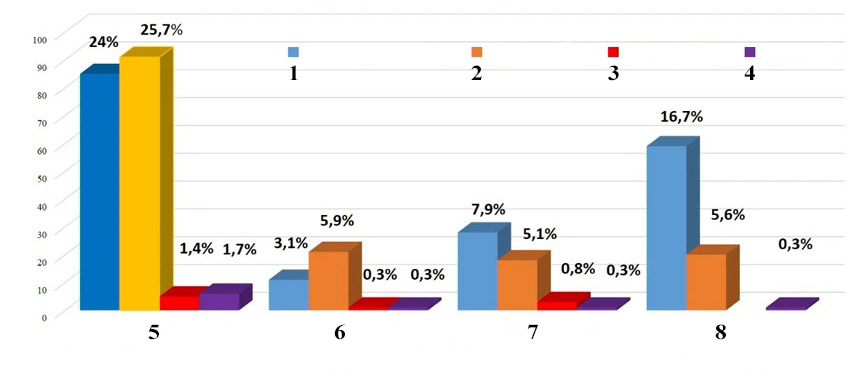
Распределение пациентов по срокам развития локализации перипротезной инфекции. 1. Тазобедренный сустав 2. Коленный сустав 3. Плечевой сустав 4. Локтевой сустав 5. Ранняя острая (до 1 месяца) 6. Ранняя отсроченная (1-3 месяца) 7. Поздняя (3 месяца – 1 год) 8. Гематогенная острая (более 1 года)
Как видно из диаграммы распределения пациентов по срокам развития и локализации ППИ, подавляющее большинство осложнений обнаружены в ранний период до 1 месяца и приходятся на тазобедренные и коленные суставы (24% ЭТС, 25,7 % ЭКС)
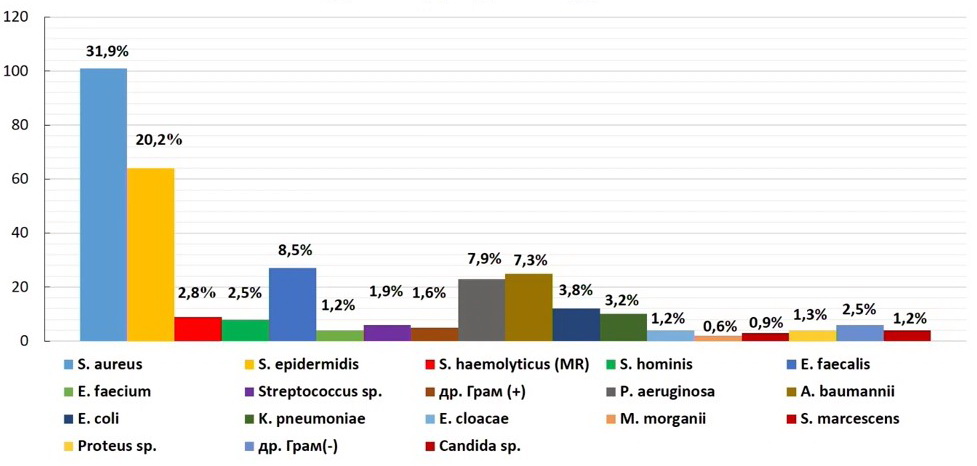
Видовая структура возбудителей
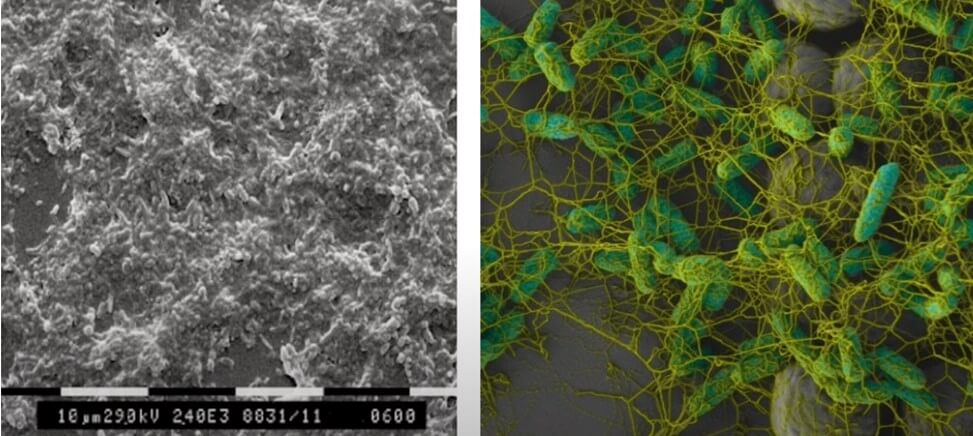
Биопленочная инфекция
Отдельно нужно выделить особое состояние микроорганизмов, которому сегодня уделяют огромное внимание во всем мире – Биопленка.
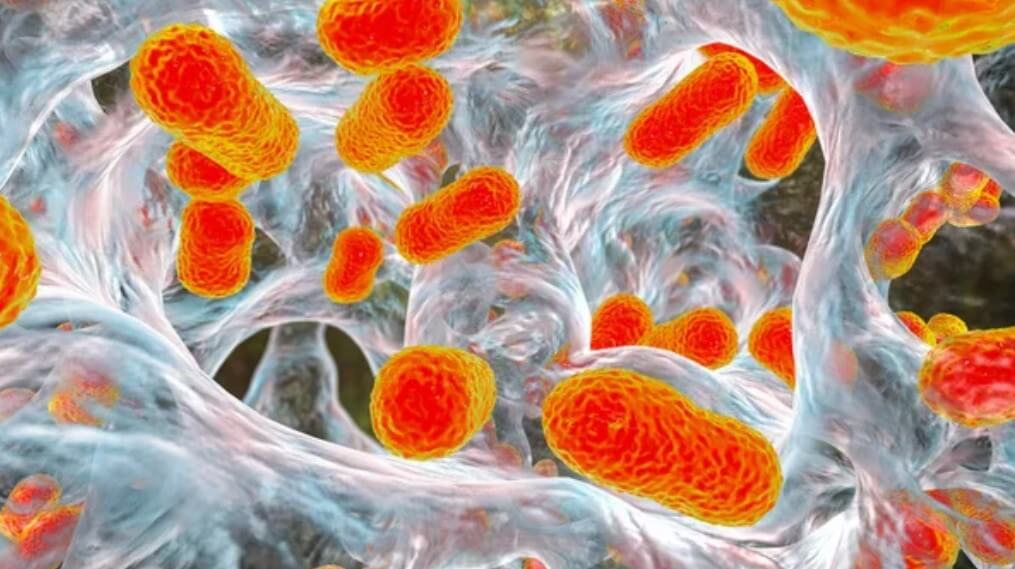
Биопленка – микробное сообщество, необратимо прикрепленных к субстрату и друг к другу и защищенных продуцируемым этими микроорганизмами внеклеточным полимерным матриксом. Они имеют измененный фенотип, проявляющийся другими параметрами роста и экспрессии, специфичность генов. Находящиеся под биопленкой микробные колонии кардинально изменяют свои свойства. Кроме роста и генома у них наблюдается большая резистентность к антибиотикам. Стоить помнить, что почти в 100% при возникновении ППИ врачи будут иметь дело с биопленочной инфекцией, устойчивой к большинству распространенных препаратов.
Основоположниками учения о медицинских бипленках считаются Джон Костертон (автор более 400 работ о биопленках), Томас Мэриэ (автор более 100 работ) и Карла Арсиола (автор более 150 работ). В их работах описаны фундаментальные принципы строения и физиологии микробных биопленок.
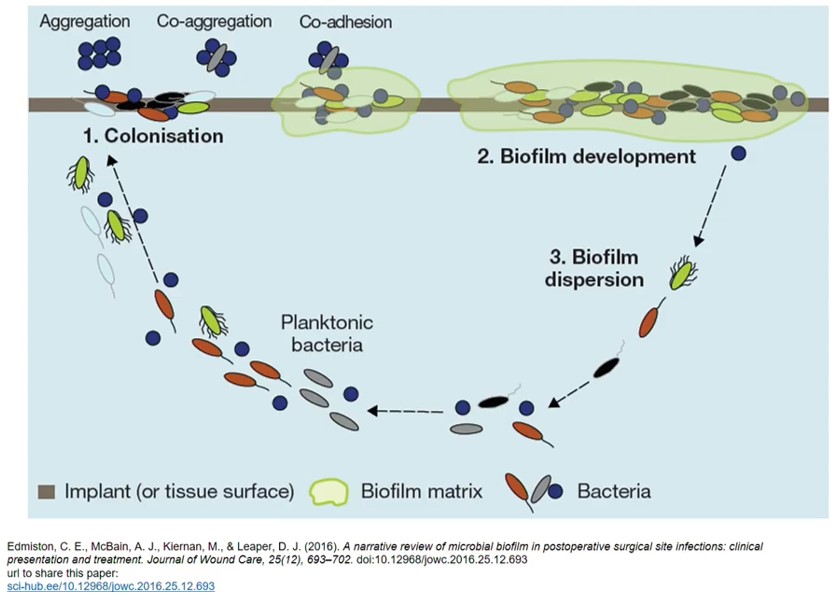 Упрощенная модель развития биопленок
Упрощенная модель развития биопленок
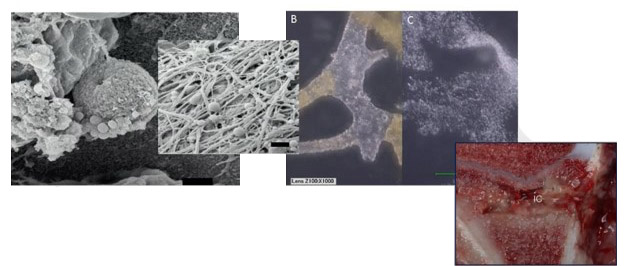
Развитие бактериальной биопленки на костной ткани
Биопленочная инфекция и ее влияние на течение хронического воспалительного процесса
Развитие воспалительного процесса неразрывно связано с формированием биопленок, защищающих микроорганизмы как от иммунного ответа со стороны организма-хозяина, так и от воздействия антибиотиков (Costerton J.W., 1999, 2014) В частности, чувствительность бактерий в биопленках к антибактериальным препаратам в 100-1000 раз ниже, чем у «планктонных» (незащищенных биопленкой) форм, что требует многократного увеличения концентрации применяемых препаратов.
Все выше указанные факторы существенно затрудняют задачу санационного процесса, а при нарушениях метаболических процессов и костного ремоделирования, когда разрушается костный матрикс, - сложность проблемы санации увеличивается многократно.
Экспериментальные лабораторные исследования показали, что планктонные бактерии, например, стафилококки, стрептококки, псевдомонады, кишечная палочка обычно присоединяются друг к другу в течение нескольких минут; образуют прочно соединенные микроколонии в течение 2-4 часов; вырабатывают внеклеточные полисахариды и становятся значительно более толерантными к биоцидам, например, к антибиотикам, антисептикам и дезинфектантам в течение 6-12 часов; вовлекаются в зрелые колонии биоплёнки, которые очень устойчивы к биоцидам и теряют планктонные бактерии в течение 2-4 дней в зависимости от видов бактерий и условий роста; быстро восстанавливаются после механического разрушения и вновь формируют зрелую биоплёнку в течение 24 часов
Биопленки и антибиотикорезистентность
Почему биопленочные инфекции в 100-1000 раз менее чувствительные к большинству антибиотиков и другим биоцидным веществам, чем планктонные клетки?
Механизмы устойчивости:
- 1. Затруднение или неспособность антибиотиков проникнуть вглубь матрикса колонии;
- 2. Связывание и инактивация антибиотика полимерами или белками матрикса;
- 3. Замедленная скорость деления бактерий в биопленках;
- 4. Наличием в биопленках метаболически неактивных клеток, нечувствительных к антибиотикам (клетки-персистеры).
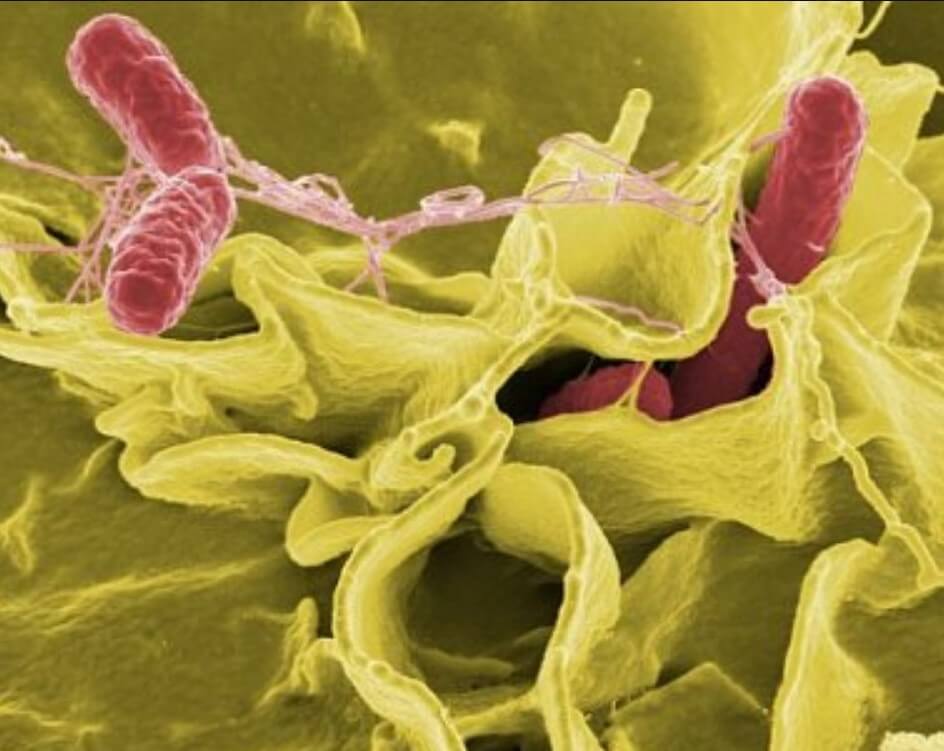
Для биопленок характерно присутствие т. н. клеток-персистеров. Клетки-персистеры - альтруистические интактные клетки, способные выживать даже при высоких дозах антибиотиков, летальных для остальных микробных клеток. По данным некоторых авторов их количество варьирует от 1 до 5 % от всей популяции и увеличивается в стационарную фазу. (Raton B. 2006). Они метаболически неактивны, а их основное назначение, по-видимому, депонирование и сохранение генетического материала для последующего восстановления популяции. Фенотип персистеров характеризуется интересной биологией, они замедляют все физиологические процессы и становятся толерантными к действию разных факторов, в том числе и к воздействию антимикробных препаратов. Свойство антибиотикотолерантности отличается от механизмов резистентности, за счет резкого замедления всех физиологических и биохимических процессов, на которые могут воздействовать антибиотики.
Именно наличие клеток-персистеров, которые могут активироваться через месяцы и годы после, казалось бы, полного излечения инфекции, делает биопленочную инфекцию при протезировании такой опасной.
Подводя итог, можно сказать, что биопленкообразование — это естественный процесс существования микроорганизмов в окружающей среде и в организме хозяина, обеспечивающий их выживание. Состояние биопленки позволяет бактериям быть толерантными к лечению антибиотиками и к воздействию факторов иммунной системы из-за структурной и метаболической гетерогенности, которая обусловлена одновременным сосуществованием микробных клеток в различных состояниях, сочетающимся с активным синтезом межклеточного матрикса. Кроме того, близость бактерий в состоянии биопленки индуцирует возможность обмена генами устойчивости к антибактериальным препаратам.
Одним из неблагоприятных последствий биопленочных инфекций является чрезмерное потребление антибактериальных препаратов (в основном без какого-либо терапевтического эффекта) в случае сохранения инфицированного имплантата, что также способствует прогрессированию устойчивости возбудителей к антибиотикам (По данным ВОЗ, устойчивость к противомикробным препаратам (Antimicrobial resistance - AMR) входит в десятку основных угроз общественному здоровью в мире. Ежегодно более 700 000 человек во всем мире умирают от устойчивых к противомикробным препаратам инфекций. Это соответствует примерно 2 000 смертельных случаев в день. По прогнозам различных аналитических центров, к 2050 году эта смертность может достичь 10 миллионов в год, если не удастся решить проблему устойчивости к противомикробным препаратам.
Профилактика образования пленок на поверхностях имплантатов представляется одним из перспективных методов борьбы с хроническими рецидивирующими имплантат-ассоциированными инфекциями. В травматологии и ортопедии в профилактических и терапевтических целях помимо системного и локального (в составе костного цемента) применения антибиотиков возможно использование различных материалов для создания имплантатов с определенными физическими и химическими свойствами поверхностей. Однако, несмотря на все оптимистичные результаты, большинство систем находятся на этапе изучения и их трудно масштабировать до отраслевых стандартов, что требует дальнейших исследований.
По-видимому, в идеале необходима технология, которая позволяет интегрировать биологическую защиту в конструкцию имплантата, обеспечивая пролонгированную антимикробную и антибиопленочную защиту в течение срока службы заменяющего протеза и не вызывая селекцию антибиотикоустойчивых штаммов бактерий.
Разбирать подробно этот вид инфекции мы не будем т.к. это отдельная огромная тема, которая имеет отчасти опосредованное отношение к травматологии-ортопедии и решением которой занимаются инфекционисты, иммунологи и микробиологи.
4 потенциальных очага инфекции при возникновении остеомиелита и ППИ
- 1. Абсцессы в мягких тканях и костном мозге – стенка абсцесса создает физический барьер, препятствующий проникновению иммунных клеток и антибиотиков, способствующий длительной персистенции возбудителей.
- 2. Биопленка на поверхности имплантатов и аллокости
- 3. Внутриклеточное паразитирование в клетках кости и иммунной системы – золотистый стафилококк может не только выживать, но и размножаться в остеобластах. Кишечный стафилококк (MRSA) способен вызывать ППИ после протезирования используя нейтрофилы кишечника в качестве «Троянского коня» (кишечный MRSA попадает в коленный сустав прячась в нейтрофилах и в последствии вызывает ППИ
- 4. Колонизация лакунарно-канальцевой системы (ЛКС). Бактерии внутри ЛКС окружены плотным минеральным матриксом кортикальной кости и полностью недоступны для иммунных клеток и антибиотиков. Одна из самых продолжительных по существованию инфекций, вызывающих остеомиелит. Зафиксирован случай существования инфекции в ЛКС около 75 лет.
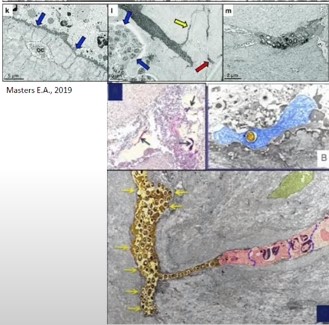
Колонизация лакунарно-канальцевой системы (ЛКС)
Несколько слов о диагностике инфекционных осложнений
Задачи диагностики состоят из:
- обнаружения
- идентификации
- определения чувствительности к антибиотикам
Если эти три задачи не выполняются, то рассчитывать на хорошие результаты лечения перипротезной инфекции не приходится. По заявлению некоторых авторов, у, примерно, 28% пациентов с перипротезной инфекцией при первичном обследовании не обнаруживают никаких возбудителей и патогенных штаммов. Это затрудняет подбор методов лечения, выбор группы антибиотиков и, соответственно, переводит инфекцию из острой в хроническую.
Существуют два метода диагностики (выявления и идентификации) культуральные и молекулярные
Культуральные методы диагностики больше подходят для выявления т.н. планктонных форм инфекции, когда возбудитель не закрыт биопленкой. Они позволяют выделить, высеять на питательную среду, вырастить, идентифицировать и подобрать действенный антибиотик с максимальной чувствительностью к нему возбудителя.
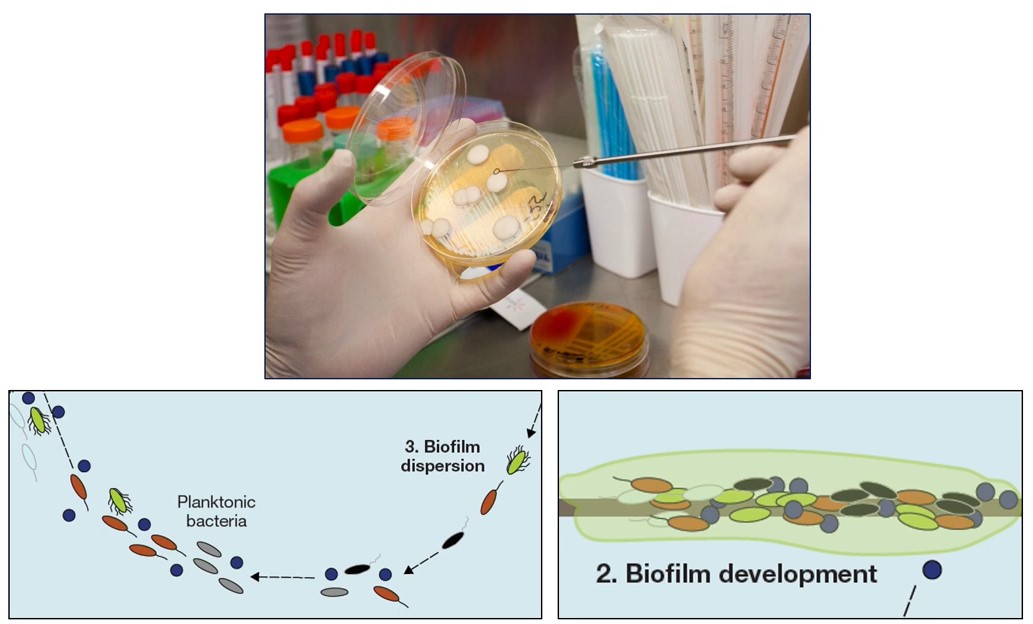
Другая проблема – биопленочная инфекция, когда присутствуют все признаки воспаления в области эндопротеза, есть явные изменения в формуле крови – высокие лейкоциты, СОЭ, фибриноген и т.д., но при посеве получаем стерильную среду. В этом случае на помощь приходит молекулярная диагностика.

Молекулярные методы диагностики
1. Полимеразная цепная реакция или ПЦР
Позволяет идентифицировать ДНК патогенов путем количественного увеличения бактериальной ДНК
2. Полимеразная цепная реакция (ПЦР) с пиросеквенированием
Позволяет идентифицировать все известные бактерии, дрожжи и грибки в образце независимости от способности микроорганизма расти внутри или на культурных питательных средах.
3. Полимеразная цепная реакция (ПЦР) с обратной транскриптазой
Представляет собой метод амплификации (увеличение числа копий РНК, ДНК) специфического фрагмента РНК. Молекулу РНК превращают в реакции обратной транскрипции, далее амплифицируют уже одноцепочную молекулу ДНК, используя традиционную ПЦР. Этот метод позволяет идентифицировать практически 100% известных возбудителей.
4. Метод идентификационных отпечатков
Денатурирующий градиентный гель-электрофорез – наиболее распространенный метод идентификации отпечатков для идентификации патогенных микроорганизмов.
5. Флуоресцентная гибридизация in situ
- FISH обнаруживает и локализует последовательности нуклеиновых кислот на внутриклеточной рРНК, используя флуоресцентный анализ олигонуклеотидов.
- FISH дают информацию как о наличии, так и о локализации патогенов.
- FISH представляет собой специфический молекулярный метод ІІ поколения, который успешно применяется в диагностике ортопедических биопленочных инфекций различной локализации.
6. Технология IBIS – основана на ПЦР-амплификации и масс-спектрометрическом анализе специфических сегментов рибосомных генов рРНК и ряда других генов бактерий.
Позволяет идентифицировать резистентные микроорганизмы, идентифицируя устойчивые к антибиотикам гены, которые кодируют устойчивость к оксациллину.
Методы лечения перипротезной инфекции
ВСЕГДА! Должен применяться комплексный мультидисциплинарный подход и комплексное лечение!
Практически во всех случаях кроме хирурга или ортопеда-травматолога задействуются микробиологи, иммунологи, терапевты, необходимые лаборатории, клинические фармакологи
Стратегии лечения хронической инфекции, направленные против биопленок это:
- физическое удаление биопленки
- точная диагностика
- терапия, направленная на разрушение биопленок
- антибактериальное лечение и профилактика
1. Физическое удаление биопленки
Радикальная хирургическая санация (дебридмент) довольно быстро уничтожает большую долю биопленочных структур.
Как правило, определенная часть биопленки, содержащей клетки-персистеры, остается на месте и может стать отправной точкой для рецидива инфекционного процесса. Т.н. «остатки» - серьёзная проблема для хирурга и истинный враг пациента, которые не всегда удается ликвидировать, особенно в условиях остеопении, когда значительно снижается плотность костной ткани и увеличивается ее пористость. Как показала практика, они могут элиминироваться только локальными высокими концентрациями антибактериальных препаратов. Также ограничением является отсутствие полного доступа к очагу инфекции.

Физическое удаление биопленки
2. Точная диагностика
- заключается в максимальной точности и возможности количественного определения ДНК патогена
- чтобы разработать комплексный план лечения, ориентированный на компоненты биопленки, необходимо провести полный микробиологический анализ
- количественная
Высокая эффективность диагностики необходима для воплощения следующих двух принципов (3 и 4) – терапии биопленок и рациональной антибиотикотерапии, представляющих собой основу плана лечения
3. Терапия, направленная на разрушение биопленок
4. Антибиотики
- прямая доставка к целевому участку ткани в высоких концентрациях, необходимых для преодоления фенотипической устойчивости биопленки
- предотвращение фармакокинетических ограничений (поглощение, метаболизм, элиминация)
- более эффективное проникновение в патологически измененные ткани (зависит от концентрации и механизма высвобождения)
- менее выраженные побочные эффекты и токсичность
- способность усиливать синергизм с антибактериальными препаратами в комбинациях из нескольких препаратов (например, фаго- и антибиотикотерапии) для усиления воздействия местного применения
- стойкое длительное высвобождение на пораженном участке
Ограничения и проблемы: доставка препарата точно к месту расположения очага инфекции, поддержание стабильной высокой концентрации, токсичность высокой концентрации для организма пациента.
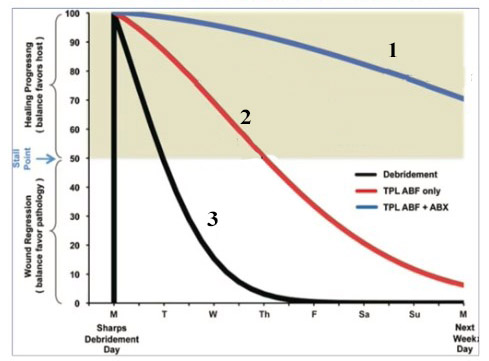
Профиль прогрессии/регрессии, иллюстрирующий комплексный подход к проблеме биоплёночной инфекции 1. Дебридмент + противобиопленочные препараты + АБ терапия 2. Дебридмент + противобиопленочные препараты 3. Дебридмент
Как отмечают многие авторы, соблюдение 4 составляющих лечения способствуют получению хороших стойких результатов лечения перипротезной инфекции. При этом, несоблюдение одного из пунктов ведут к резкому ухудшению результатов лечения и получения рецидивов.
Отдельно хотелось бы обратить внимание на увеличение статистики появления перипротезной инфекции при плановых операциях у пациентов, переболевших COVID-19, которую отмечают последние годы во всём мире. Нарушения со стороны иммунитета, немотивированное назначение антибиотиков при лечении вирусной инфекции, применение гормонов при лечении COVID-19, привели к распространению антибиотико-резистентных инфекций и увеличения числа инфекционных осложнений при эндопротезировании больших суставов.
Профилактика и лечение ППИ
К профилактическим мерам относятся:
- четкое соблюдение правил асептики и антисептики
- санация возможных очагов инфекции (зубы, горло, нос, инфекционные поражения кожных покровов и т.д.)
- отказ от курения и алкоголя или максимальное ограничение минимум за 4 недели до плановой операции по эндопротезированию
Лечение ППИ
Как мы уже писали, лечение должно быть комплексным и многопрофильным. К сожалению прогноз лечения остеомиелита и ППИ очень неблагоприятный, а процент рецидивов иногда превышает 25%.
О специфике лечения данного осложнения мы писать не будем, т. к. это очень сложный и индивидуальный в каждом случае, процесс, к тому же не до конца оформившийся в работающий алгоритм. Скажем только, что лечением ППИ и остеомиелита занимаются высокопрофильные клиники и отделения с огромным опытом работы в данной области. Еще хотелось бы добавить, что эта проблема мирового масштаба и на решение ее ежегодно выделяют сотни миллионов долларов, создаются специальные фонды для борьбы и изучения антибиотико-резистентной инфекции.
Перспективы лечения ППИ
Практически во всех развитых странах идет каждодневная работа по изучению методов борьбы с биопленочной и антибиотико-резистентной инфекцией. На данный момент существуют перспективнее разработки, но, к сожалению, они далеки от масштабного клинического применения.
Вот одна из них
Микробиологи научились «рвать» биопленки до их окончательного формирования
«Микробиологи из Мэрилендского университета в Колледж-Парке обнаружили, что фермент олигорибонуклеаза эффективно подавляет обмен химическими сигналами между отдельными клетками бактерий. С его помощью можно приостановить, а в ряде случаев и предотвратить образование биопленки из бактерий на ранних стадиях ее формирования. По мнению ученых, их открытие поможет в разработке нового класса антибиотиков - Oligoribonuclease is the primary degradative enzyme for pGpG in Pseudomonas aeruginosa that is required for cyclic-di-GMP turnover статья опубликована в журнале Proceedings of the National Academy of Sciences.
Иногда, обычно при неблагоприятных условиях среды, многие виды бактерий образуют биопленку – протяженную колонию микроорганизмов защищенную особым белковым барьером. В колонии отдельные клетки бактерий соединены друг с другом с помощью матрикса – специализированных белков, которые микроорганизмы выделяют во внешнюю среду. Ранее было установлено, что одним из важнейших этапов в формировании биопленки играет предварительный обмен между бактериями особыми сигнальными молекулами – циклическими дигуанилатами (цикло-диГМФ). Так, их используют для образования биопленки такие широко известные бактерии как кишечная палочка (Escherichia coli), холерный вибрион (Vibrio cholerae), золотистый стафилококк и др.
В опытах с бактерией синегнойной палочки (Pseudomonas aeruginosa) выяснилось, что фермент олигорибонуклеаза – катализирующий деградацию РНК и, в частности, расщепляющий короткие олигонуклеотиды (короткие фрагменты РНК) до мононуклеотидов (отдельных азотистых оснований), способен подавлять обмен химическими сигналами. Он участвует в деградации циклического дигуанилата и препятствует дальнейшей выработке так называемых белков множественной лекарственной устойчивости.
Из-за высокой устойчивости биопленки к антибиотикам и другим противомикробным препаратам, она представляет серьезную проблему для медицинских учреждений. В ряде случаев, биопленки образуются на плохо продезинфицированном медицинском оборудовании, что вынуждает прибегнуть к его замене. Однако наибольшую опасность представляет появление биопленки на имплантатах, например, на электрокардиостимуляторах, эндопротезах или алотрансплантатах. В связи с тем, что устойчивость биопленки из бактерий может в десятки тысяч раз превышать устойчивость тех же самых микроорганизмов, но в планктонном виде – разработка новых эффективных препаратов для предотвращения образования или ее подавления является одной из приоритетных задач современной фармакологической индустрии».
P.S. Локальное инфицирование при самолечении народными средствами может закончиться общей интоксикацией, сепсисом и летальным исходом.
Специалисты и клиники, которые помогут Вам с диагностикой и лечением ППИ
Лаборатория микробиологии и химиотерапии ГУ «Институт травматологии и ортопедии НАМН Украины»

- Адрес:
- 01601, г. Киев, ул. Бульварно-Кудрявськая, 27, 1 этаж поликлинического корпуса ГУ «Институт травматологии и ортопедии НАМН Украины», вход со стороны переулка Чеховський, 7 (отдельный вход со двора)
- Контакты:
- +38 (044) 486-60-67
- График работы:
- 9 00 – 16 00 понедельник - четверг
- 9 00 – 15 00 пятница
- Суббота, Воскресенье - выходной
Отделение костно-гнойной хирургии ГУ "ИТО НАМНУ"

- Адрес:
- ул. Бульварно-Кудрявская, 27, г. Киев 01601 7 этаж главного корпуса (левое крило)
- Телефон:
- +38 (044) 486-69-83
- Сайт:
- https://ito.gov.ua/
- График роботы:
- Понедельник – Пятница с 9:00-17:30
- Дни консультаций:
- Четверг с 9:00-14:00
- Операционные дни:
- Понедельник, Среда
